Для химика пламя не только источник тепла, но и инструмент химического анализа. Давно известно, что некоторые химические соединения, введенные в пламя, придают ему характерную окраску. В этом можно убедиться, если в любое пламя внести кусочек поваренной соли.
Возьмите кусок нихромовой проволоки (например, из старого утюга) длиной 10 см и выпрямите. Для опыта понадобится еще стеклянная трубка из легкоплавкого стекла. Надо заплавить проволоку в стеклянную трубку при помощи газовой горелки. Потом на конце проволоки сделайте маленькую петельку, как показано на рисунке. 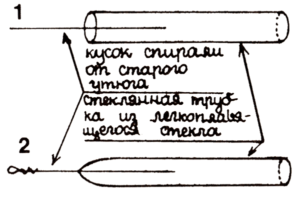
Можно поступить не совсем спортивно и заменить стеклянную трубку корковой пробкой из винной бутылки.
При подведении определенного количества воздуха пламя газовой горелки становиться голубым и не коптит. Отчетливо видны в нем две части. Внутренняя часть называется восстанавливающей. Она голубого цвета и имеет сравнительно низкую температуру. Внешняя часть бесцветная — окисляющая. Температура этой части пламени равно около 1300 °С.
Растворите в нескольких миллилитрах воды, налитых в пробирку щепотку хлористого натрия. Очищенную проволоку погрузите в раствор, а потом введите в окисляющую часть пламени.

Какой великолепный эффект! Пламя в одно мгновение меняет окраску на интенсивно желтую. А теперь проверьте, содержит ли натрии вода, которую вы пьете (этот металл придает пламени желтый цвет). Результат анализа будет положительным. Можете проверить, содержат ли натрий другие вещества. Окажется, что натрий «пронырливый» металл, везде он есть, пламя всегда будет более или менее желтым.
Если вы уже знаете, как меняет окраску пламени натрий, проверьте «поведение» других металлов. Возьмите образцы солей кальция, стронция, бария, калия и меди. Лучше всего взять хлориды или нитраты. Если у вас их нет, возьмите другие соли, но помните, что сначала проволоку нужно очистить в пламени и соляной кислоте. После такой очистки опять опускайте проволоку в раствор анализируемого вещества, а затем вводите в окисляющую часть пламени.
При анализе твердых субстанций раскаленную проволоку опускают в анализируемое вещество, которое прилипает к ней и затем сплавляется в пламени горелки, образуя перл. Перл на мгновение опускают в соляную кислоту. Образующиеся при этом хлористоводородные соединения летучие и быстро испаряются с проволоки в пламени, окрашивая его в характерный цвет.
Вероятно вы удивитесь, когда начнете исследовать калий, так как цвет пламени будет такой же как в ходе анализа натрия, и лишь время от времени через желтое пламя будут проскакивать розовые отблески калия. Это потому, что натрий, содержащийся в воде, употребляемой для растворения образца, не позволяет калию показать себя в полной красоте. В пламени идет „борьба” между натрием и калием, в которой натрий побеждает. Если хотите, можете помочь победить калию. Наблюдайте через так называемое синее кобальтовое стекло. Это стекло представляет собой фильтр, который задерживает цвет натрия, пропуская цвет калия. Вы, наверное, огорчитесь, что в вашей лаборатории нет кобальтового стекла. Но не падайте духом, вместо него можно взять раствор метилового фиолетового. А если его тоже нет, растворите в воде несколько капель синих чернил. Если будете наблюдать пламя через этот раствор, увидите фиолетовую вспышку, свидетельствующую о наличии калия.
А теперь сопоставьте результаты работы:
Металл Цвет пламени
барий зеленый
стронций ало-красный
кальций кирпично-красный
медь зелено-синий
натрий желтый
калий розово-фиолетовый
литий красный
Медный факел
Зная, что некоторые металлы окрашивают пламя, сделайте медный «факел». Это необыкновенно интересный опыт. Соберите аппаратуру, показанную на рисунке.
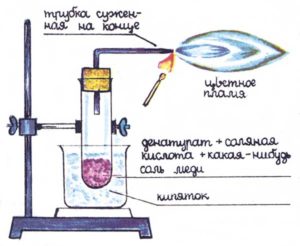
Всыпьте в пробирку несколько криеталликов какой-либо соли меди, например, CuSO4 (медный купорос), и добавьте до 1/3 высоты пробирки денатурат и несколько капель разбавленной соляной кислоты Закупорьте пробирку пробкой, через которую проходит трубка, изогнутая под прямым углом и суженая на конце. Поместите пробирку в химический стакан с горячей водой, денатурат начнет испаряться, увлекая с собой соль меди. Приставьте к выходу трубки горящую спичку: пары денатурата зажгутся, а пламя приобретет зелено-синий цвет. Эффект опыта необыкновенно красив, если его наблюдать в темной комнате.
А теперь модифицируйте опыт, взяв вместо соли меди ранее употреблявшиеся химические соединения, окрашивающие пламя. А если у вас есть бура или борная кислота, проверьте, как окрашивает пламя бор. Борную кислоту можно купите в аптеке. И еще одно: не заливайте пробирку более чем на 1/3 высоты. И ни в коем случае не нагревайте пробирку горелкой!
Цветные свечи
Чтобы получить свечи с разноцветным пламенем надо добавить в расплавленный парафин соль металла, окрашивающего пламя в той или иной цвет.
Синяя свеча. Покрасить парафин в синий цвет можно стеаратом меди. Эту соль получают смешивая растворы сульфата меди и хозяйственного мыла. Пламя свечи тоже будет синим, благодаря ионам меди.
Зеленая свеча. В качестве пигмента используется зеленый оксид хрома (III). Он получается при термическом разложении бихромата аммония (опыт с вулканом). Цвет пламени тоже будет зеленым.
Желтая свеча. Желтый хромат натрия окрасит парафин и пламя свечи в желтый цвет.
Красная свеча. Парафин подкрашивают любым красным пигментом, например гуашью. Чтобы пламя было красным надо добавитькакую-либо соль стронция или лития.
Библиография
- Кшиштоф Кушмерчик, журнал «Горизонты техники для детей» 1989-3